Il Centro di Fertilità e di Procreazione Medicalmente Assistita della Clinica Polispecialistica San Carlo è attivo nei programmi di fecondazione assistita omologa di I livello (Inseminazioni Intrauterine – IUI) e di II e III livello (fecondazione in vitro mediante tecniche quali FIVET, ICSI, recupero chirurgico di spermatozoi testicolari mediante tecnica TESE e microTESE) e fecondazione assistita eterologa di I livello e II livello.
Il nostro Centro PMA mette al servizio delle coppie la professionalità e l’esperienza di ginecologi, andrologi, biologi, genetisti, endocrinologi e ostetriche, specializzati nell’individuazione dei percorsi diagnostico-terapeutici e di cura più adeguati a singoli casi, promuovendo una altissima qualità assistenziale, facendo ricorso a tecniche di ultima generazione, che ottimizzino le possibilità di gravidanza, riducendo al minimo i rischi correlati alle tecniche. Un percorso che vede coinvolti nella nostra equipe anche psicologi che accompagnano la coppia in tutte le fasi di cura.
Il nostro Centro è specializzato nella gestione del fattore maschile di infertilità, a partire da alterazioni seminali medio-severe, fino a condizioni estreme come i casi di azoospermia non ostruttiva (assenza di spermatozoi nel liquido seminale per patologia testicolare primaria), avvalendosi di una équipe di andrologi, biologi ed embriologi che ha maturato una delle maggiori esperienze in Italia nel recupero chirurgico di spermatozoi testicolari e nel loro utilizzo per fecondazione in vitro.
Inoltre, per quanto riguarda la diagnostica, l’équipe biologica del Centro esegue test seminologici di II livello e III livello, mirati a identificare alterazioni degli spermatozoi non evidenziabili durante un esame standard del liquido seminale.
Tali test, oltre alla visita andrologica e agli altri accertamenti clinici indicati caso per caso (ecodoppler scrotale, ecografia prostato-vescicolare, esami ormonali e genetici), consentono al clinico di impostare un percorso terapeutico mirato, a seconda delle alterazioni e patologie rilevate durante lo studio dell’uomo nella coppia infertile.
La nostra attività prevede anche la crioconservazione dei gameti femminili e maschili.
Questa tecnica permette di preservare la fertilità nei soggetti affetti da patologie benigne o maligne, a rischio di compromissione irreversibile della funzione gonadica, oppure anche solo in quelli che desiderino posticipare la propria genitorialità (social freezing).
Il nostro Centro eroga prestazioni sia in convenzione con il Sistema Sanitario Nazionale sia in regime privato. E’ strutturato ed organizzato per poter gestire, nel modo più adeguato, anche coppie di pazienti provenienti da sedi fuori Regione.
Durante la prima visita di consulenza presso il Centro, viene identificato l’iter diagnostico-terapeutico più adatto alla coppia e vengono poste le condizioni affinché lo stesso si realizzi attraverso un progetto di cura dedicato.
Infertilità di coppia
Con il termine di infertilità di coppia si intende l’assenza di concepimento spontaneo dopo almeno 12 mesi di rapporti liberi dall’uso di qualsiasi anticoncezionale orale o meccanico: questa definizione corrisponde pertanto ad un dato clinico riferito dalla coppia, per cause da identificare mediante esami specifici sull’uomo e sulla donna.
Al contrario, si definisce sterilità della coppia la documentata e assoluta impossibilità al concepimento spontaneo (per esempio, per l’assenza di spermatozoi nell’eiaculato, per impervietà tubarica bilaterale, per grave endometriosi, ecc.).
L’infertilità di coppia può dipendere sia da fattori maschili che femminili e in alcuni casi da fattori di entrambi i partner.
Infertilità femminile
Le cause di infertilità femminile sono numerose, e vengono schematicamente indagate a livello cervicale, uterino, tubarico, ovarico.
Quali sono le cause di infertilità femminile?
- età (dopo i 35 anni generalmente le possibilità di concepimento si riducono con l’aumento dell’età)
- riduzione riserva ovarica
- infezioni genito-urinarie
- patologie ovariche e/o ormonali e/o squilibri ormonali
- malformazioni congenite
Le indagini debbono essere orientate sulla base:
- della presenza e della regolarità dei cicli mestruali;
- di precedenti anamnestici di infezioni genito-urinarie (indici indiretti di alterazioni dell’ambiente vaginale, dove avviene l’interazione muco cervicale-spermatozoi);
- di precedenti interventi chirurgici effettuati sull’addome o sulla pelvi (fattori di rischio per la pervietà delle tube).
- di dati obiettivi quali la presenza di acne e/o irsutismo (possibili indici di alterata secrezione ormonale ovarica e surrenalica);
- dei reperti alla visita ginecologica (che valuta manualmente posizione, volume dell’utero e sua regolarità, e le condizioni della vagina e del collo uterino).
Infertilità maschile
Nel caso in cui lo spermiogramma presenti alterazione di almeno un parametro in due esami successivi, opportunamente distanziati di 3 mesi l’uno dall’altro, si parla di infertilità maschile.
- La più comune alterazione del liquido seminale è la oligo-asteno-teratospermia (OAT), ovvero una riduzione del numero degli spermatozoi, della percentuale di motilità e della percentuale di morfologia normale (Manuale WHO; 2021).
- La Azoospermia è la assenza completa di spermatozoi nel liquido seminale.
Quali sono le cause di infertilità maschile?
- problematiche endocrinologiche, con alterazione dell’asse ormonale che regola l’attività testicolare
- pregresse flogosi testicolari e della via seminale (epididimiti, prostatiti, uretriti,..)
- subostruzioni delle vie seminali, generalmente conseguenti a traumi o processi flogistici
- elevato indice di frammentazioen del DNA spermatico
- varicocele
- pregressa storia clinica di criptorchidismo
- pregressi traumi genitali
- pregresse terapie chirurgiche demolitive e/o trattamenti chemioterapici
- anomalie anatomiche congenite delle vie seminali
L’infertilità maschile può essere idiopatica: non sono, cioè, riconosciute cause specifiche della (progressiva) riduzione della funzione riproduttiva (30-40% degli uomini infertili).
Durante il consulto andrologico, viene eseguita una valutazione clinica completa e prescritti i necessari approfondimenti per accertare le cause dell’infertilità e valutare le possibili terapie.
Gli approfondimenti diagnostici sull’uomo infertile che eseguiamo nel nostro Centro possono comprendere anche:
- test di II e III livello sul liquido seminale (tra cui quello sulla frammentazione del DNA spermatico)
- ecocolordoppler scrotale e, in casi selezionati, ecografia prostatica
- dosaggi ormonali: FSH, LH, testosterone totale, prolattina, Estradiolo
- screening genetici: cariotipo; studio del Gene dell fibrosi Cistica; ricerca delle microdelezioni del cromosoma Y
AZOOSPERMIA
Il nostro Centro si distingue in particolare per la gestione della Azoospermia, ovvero la assenza di spermatozoi su due campioni di liquido seminale.
Esistono due forme si azoospermia:
- ostruttiva (25-30% dei casi), OA, cioè causata da una ostruzione delle vie seminali (che non permette il transito degli spermatozoi, prodotti normalmente dai testicoli)
- non-ostruttiva (70-75% dei casi), NOA, dovuta cioè ad una problematica testicolare primaria, che comprende diverse presentazioni della struttura interna del testicolo (ipospermatogenesi severa, arresto maturativo completo o incompleto, sindrome a sole cellule di Sertoli, ecc.).
Le principali tecniche di recupero chirurgico di spermatozoi sono rappresentate da:
• TESE (Testicular Sperm Extraction), che viene eseguita in anestesia locale, con escissione di piccolo frammento di tessuto testicolare per la ricerca e la crioconservazione degli spermatozoi.
Questa tecnica è indicata sicuramente nelle Azoospermia ostruttiva (OA) e nei casi di oligospermia severa o criptospermia (rari spermatozoi visibili dopo centrifugazione del liquido seminale), laddove il numero e/o la qualità dei gameti non garantisca una ragionevole probabilità di successo con tecniche di fecondazione in vitro (ad esempio, nei casi ove nel liquido seminale sia presente anche una elevata percentuale di spermatozoi con DNA frammentato).
• MicroTESE (Microsurgical Testicular Sperm Extraction), tecnica indicata nei casi di Azoospermia non ostruttiva (NOA). La MicroTESE viene eseguita in anestesia generale e prevede l’esame approfondito con microscopio operatore (sino a 24 ingrandimenti) del tessuto testicolare: in tal modo, è possibile eseguire microprelievi selettivi delle aree di tessuto che più probabilmente contengono spermatozoi (ovvero, quelle con microtubuli più dilatati). Il Biologo lavora in contemporanea in sala operatoria, valutando in tempo reale la presenza, il numero e la qualità degli spermatozoi, mediante esame di alcune aliquote di tessuto esaminato.
(Linee Guida della European Association of Urology e della American Urology Association).
Gli spermatozoi recuperati da microTESE vengono utilizzati per la fecondazione in vitro (ovvero la tecnica ICSI, ‘iniezione intracitoplasmatica di spermatozoi’): le percentuali di successo dipendono anche dalla lunga esperienza dei Biologi, che cercano gli spermatozoi nel tessuto prelevato, e degli Embriologi, che li utilizzano per la fecondazione degli ovociti.
In casi selezionati, è possibile proporre un prelievo testicolare ‘a fresco’, con TESE o con microTESE: in questo caso, si procede a contemporaneo prelievo, nella stessa giornata, di spermatozoi e ovociti nella partner femminile, per procedere a fecondazione immediata, evitando, su questo primo ciclo, il passaggio di crioconservazione e scongelamento degli spermatozoi (naturalmente, i gameti recuperati in più vengono crioconservati per i cicli successivi).
VARICOCELE
Dilatazione delle vene del plesso pampiniforme, responsabili del drenaggio del testicolo, a livello inguino-scrotale.
È una condizione che colpisce principalmente il testicolo sinistro, anche se raramente può presentarsi a destra o bilateralmente.
Il varicocele insorge tipicamente dopo la pubertà (15-25 anni), molto raramente durante l’infanzia ed eccezionalmente dopo la quarta decade di vita.
Le potenziali conseguenze del varicocele sono un aumento della temperatura intratesticolare, la mancata eliminazione di prodotti del metabolismo testicolare e, non ultima, il reflusso di prodotti catabolici prodotti dal rene e dalla ghiandola surrenalica. Clinicamente il paziente può essere asintomatico o riferire un senso di peso a livello del testicolo; se ben sviluppato, alla autopalpazione il paziente può avere la sensazione, come in modo colorito riporta un libro americano, di palpare come “un groviglio di lombrichi” al di sopra del testicolo.
Numerosissimi studi clinici associano il varicocele ad una qualità dello sperma inferiore alla norma e, nei bambini, ad un minor sviluppo del testicolo omolaterale.
Non esiste terapia medica per questa patologia.
La diagnosi di varicocele viene posta solitamente durante la visita medica, tuttavia resulta indispensabile per la sua corretta valutazione eseguire un Ecografia con Eco-Color-Doppler dei vasi spermatici.
Nei giovani adulti (dai 17-18 anni in su), la valutazione dopo riscontro di varicocele comprende la esecuzione di almeno uno o due esami qualitativi del liquido seminale, per determinare il livello della fertilità.
TECNICHE DI CORREZIONE DEL VARICOCELE
La correzione del varicocele ha lo scopo di risolvere la dilatazione venosa presente a livello scrotale impedendo al sangue di refluire verso il testicolo.
TECNICHE CHIRURGICHE
La legatura chirurgica della vena aspermatica o delle vene del plesso pampiniforme può essere eseguita con diverse tecniche, che vengono praticate dalla nostra equipe andrologica:
- legatura con incisione chirurgica alla spina iliaca: tecnica di Palomo o tecnica di Ivanissevich. Questi approcci sono impiegati prevalentemente nei varicoceli molto voluminosi e nei pazienti in età pediatrica e adolescenziale
- legatura e sclerotizzazione delle vene spermatiche per via subinguinale: nella maggior parte dei varicocele in pazienti adulti, si propone una tecnica con incisione poco sopra la sacca scrotale, l’isolamento delle vene del funicolo e la iniezione di una sostanza sclerosante che le oblitera interrrompendoa in questo modo il reflusso di sangue (tecnica di Tauber o di Marmar modificata). La percentuale di complicanze e recidive, nella nostra lunga esterienza, risulta sovrapponibile alla tecnica microchirurgica.
- legatura microchirurgica con incisione inguinale (tecnica sec, Marmar): questa tecnica rappresenta il gold-standard secondo le Linee Guida internazionali (Eutropean Association of Urology – EAU, 2024) relativamente a efficacia e ridotta percentyuale di complicanze. Come svantaggio tuttavia, presenta maggiori tempi orperatori e la necessità di una strumenzaione specifica.
- legatura delle vene spermatiche per via laparoscopia: tecnica che non viene praticata dall nostra equipe, necessitantye di strumentario specifico e non scevra da costi elevati.
TECNICA PERCUTANEA
La scleroembolizzazione radiologica percutanea non comporta un taglio chirurgico ma un accesso vascolare percutaneo, in genere attraverso la vena brachiale o succlavia destra, con esecuzione di una flebografia del sistema venoso di sinsitra e, ove possibile, la interruzione del reflusso venoso mediante introduzione di sostanza sclerosante o piccole spirali.
ELEVATA FRAMMENTAZIONE DEL DNA SPERMATICO
Negli utlimi anni, è emerso come il solo esame seminale di base (conta, motilità, morfologia), non rensda conto di tutti gli aspetti della fertilità maschile.
In particolare, sono stati sviluppati test che studiano l’integrità e la maturazione del DNA spermatico: questo parametro può influenzare in varia misura le probabilità di concepimento spontaneo, i risultati delle IUI (inseminazioni intrauterine) e anche della fecondazione in vitro (FIVET e ICSI). Tra tutti questi scenari possibili, la ICSI sembrerebbe la tecnica meno suscettibilile
I test che vengono eseguiti nel nostro Centro per lo studio della frammentazione del DNA spermatico sono illustrati nella sezione Diagnostica di Laboratorio.
In caso di elevata frammentazione del DNA spermatico, è possibile procedere a selezione degli spermatozoi mediante tecnica di Microfluidica e di M.A.C.S. (vedi ‘METODICA DI SELEZIONE DEGLI SPERMATOZOI’).
PRELIEVO CHIRURGICO DI SPERMATOZOI TESTICOLARI IN PAZIENTI NON AZOOSPERMICI CON ELEVATO TASSO DI FRAMMENTAZIONE DEL DNA SPERMATICO (SU EIACULATO)
Le Linee Guida internazionali (European Academy of Andrology Guideline on OligoAsthenoTeratospermia, 2018; European Association of Urology , 2024) considerano la possibilità di prelevare spermatozoi testicolari per fecondazione in vitro (ICSI – Intra Cytoplasmic Sperm Injection) sulla base di studi (iniziati quasi vent’anni fa) che evidenziano un maggiore tasso di frammentazione del DNA spermatico negli spermatozoi dell’eiaculato di pazienti oligoastenospermici rispetto agli spermatozoi testicolari.
Le cause di un elevato tasso di frammentazione del DNA spermatico possono essere molte, e vanno indagate in sede clinica: varicocele, infezioni e/o subostruzioni del tratto genito-urinario, fumo di sigaretta, assunzione di farmaci, calore costante in sede testicolare,…
Poichè i risultati della ICSI possono essere condizionati negativamente, in termini di fertilizzazione degli ovociti e qualità embrionaria, in caso di elevata percentuale di frammentazione del DNA spermatico, le Linee Guida suggeriscono di discutere attentamente con la coppia vantaggi e svantaggi del prelievo testicolare (TESE – Testicular Sper Extraction), in particolare dopo esito negativo di almento uno / due cicli di fecondazione in vitro.
Questa procedura può ottenere i migliori risultati se eseguita ‘a fresco’, ovvero temporizzata con il pick up degli ovociti, in caso selezionati, modalità che permette di evitare agli spermatozoi il ciclo di crioconservazione – scongelamento (quest’ultimo potenzialmente vcausa di fremmentazione del DNA spermatico).
Fecondazione Omologa
La fecondazione in vitro omologa è l’insieme delle procedure mediche che supportano o compensano uno o più aspetti della funzione procreativa, per consentire o aumentare le probabilità di concepimento e d’impianto di una gravidanza mediante l’utilizzo degli ovociti e degli spermatozoi della coppia.
I livelli di procreazione medicalmente assistita sono tre:
1° livello
Comprende le metodiche mirate ad aumentare le probabilità di concepimento cercando di ottenere una fecondazione “in vivo” (all’interno del corpo femminile):
- induzione dell’ovulazione per rapporti mirati
- inseminazione intrauterina (IUI o Intrauterine Insemination): viene stimolata l’ovulazione mediante farmaci contenenti ormone follicolo-stimolante e si monitora lo sviluppo dei follicoli (tramite ecografia e talvolta anche con prelievi ormonali); in seguito si deposita il seme del partner (adeguatamente trattato) nella cavità uterina, per favorire l’incontro con i gameti femminili (ovociti) mediante un sottile catetere.
2°-3° livello
Con la fecondazione in vitro omologa, l’incontro tra ovocita e spermatozoo della coppia avviene in laboratorio e dunque al di fuori del corpo umano. Dopo aver indotto un’ovulazione multipla mediante la stimolazione delle ovaie, si procede al prelievo degli ovociti (pick-up ovocitario) e nella stessa giornata il partner maschile procede alla raccolta del liquido seminale. Una volta ottenuti i gameti femminili e maschili, ci sono due possibilità di fecondazione:
FIVET (fecondazione in vitro embryo transfer – IVF – In vitro Fertilization): ovociti e spermatozoi vengono posti insieme in una piastra con terreno di coltura adatto e si lascia che gli spermatozoi penetrino l’ovocita in modo naturale.
ICSI (iniezione intracitoplasmatica dello spermatozoo): microiniezione di un singolo spermatozoo direttamente all’interno della cellula uovo. È riservata ai casi in cui viene valutato che, con la semplice inseminazione dell’ovocita, possano esserci problemi nell’ottenere la fecondazione.
È considerata una metodica di PMA di III livello, quando è necessario l’utilizzo di spermatozoi prelevati chirurgicamente dal testicolo. Dopo la fecondazione, gli ovociti sono tenuti in coltura in laboratorio e trascorsi 2-6 giorni dalla fecondazione sono trasferiti nell’utero femminile (transfer embrionario).
Il Centro PMA di Clinica San Carlo offre la possibilità di ricorrere a tecniche di procreazione medicalmente assistita di tipo omologo sia privatamente che con il Sistema Sanitario Nazionale.
IL NOSTRO PERCORSO
PMA omologa di I livello
Le fasi di questo percorso prevedono diversi steps diagnostico – terapeutici:
- consulenza specialistica per fertilità: valutazione clinica e della storia della coppia da parte dei nostri ginecologi e andrologi esperti in fisiopatologia della riproduzione con lo scopo di indentificare le cause dell’infertilità, prescrizione degli esami utili all’inquadramento e alla scelta per percorso terapeutico.
- controllo esami e pianificazione del percorso più idoneo: visione dei risultati degli esami prescritti, richiesta di ulteriori valutazioni specialistiche e scelta del percorso terapeutico (PMA omologa di I o II o III livello).
- stimolazione ovarica controllata: viene indotta una blanda crescita follicolare multipla (massimo 2-3 follicoli) attraverso l’iniezione sottocutanea di basse dosi di gonadotropine (ormone follicolostimolante) o, in casi selezionati, mediante l’assunzione orale di citrato di clomifene. Dopo alcuni giorni di terapia, si inizia un monitoraggio ecografico dell’ovulazione per valutare il numero e le dimensioni dei follicoli (se indispensabile si esegue un dosaggio di estradiolo e progesterone plasmatico).
Dopo aver raggiunto un diametro follicolare corretto (intorno ai 18 mm), si procede prima all’induzione dell’ovulazione mediante l’iniezione sottocutanea di HCG.
- inseminazione intrauterina (IUI): circa 36 ore dopo l’induzione dell’ovulazione si procede alll’inseminazione in ambulatorio, trasferendo in utero degli spematozoi precedentemente trattati in laboratorio al fine di renderli idonei alla fecondazione mediante l’utilizzo di un catetere morbido introdotto attraverso la vagina e il collo dell’utero.
Dopo 14 giorni dalla procedura viene richiesta l’esecuzione di test di gravidanza.
PMA omologa di II e III livello
Le fasi di questo percorso prevedono diversi steps diagnostico – terapeutici:
- consulenza specialistica per fertilità: valutazione clinica e della storia della coppia da parte dei nostri ginecologi e andrologi esperti in fisiopatologia della riproduzione con lo scopo di indentificare le cause dell’infertilità, prescrizione degli esami utili all’inquadramento e alla scelta per percorso terapeutico.
- controllo esami e pianificazione del percorso più idoneo: visione dei risultati degli esami prescritti, richiesta di ulteriori valutazioni specialistiche e scelta del percorso terapeutico (PMA omologa di I o II o III livello).
- stimolazione ovarica controllata: stimolazione ormonale delle ovaie mediante punture sottocutanee, accompagnate da un monitoraggio ecografico e ormonale ogni 2-3 giorni al fine di valutare l’andamento della risposta alla stimolazione ormonale (3-4 ecografie nell’arco di 12-14 giorni circa).
- prelievo ovocitario: prelievo degli ovociti della partner femminile effettuato in sedazione profonda (previa visita anestesiologica). Contestuale raccolta del liquido seminale e/o scongelamento degli spematozoi crioconservati da eiaculato o da prelievo chirurgico testicolare.
- fecondazione in vitro e coltura embrionale: inseminazione mediante tecnica FIVET o ICSI degli ovociti prelevati con gli spermatozoi (freschi o scongelati) e successiva coltura in vitro degli embrioni ottenuti.
- eventuale crioconservazione embrionaria: eventuale crioconservazione degli embrioni sovrannumerari o di tutti gli embrioni in caso di specifiche condizioni cliniche (rischio di iperstimolazione e/o endometrio non idoneo) mediante tecniche di vitrificazione.
- traferimento embrionale (ET) e successivo test di gravidanza: trasferimento in utero dell’embrione (fresco o scongelato) tramite sottile catetere sotto guida ecografica e successivo test di gravidanza mediante prelievo di sangue.
Fecondazione Eterologa
La riproduzione assistita eterologa comprende un insieme di tecniche di fecondazione assistita che prevedono l’impiego di gameti (ovociti e/o spermatozoi) ottenuti da una donazione volontaria di un donatore/una donatrice esterni alla coppia.
Si ricorre alla riproduzione assistita eterologa qualora le tecniche di riproduzione assistita omologa non siano in grado di valicare la problematica di coppia nel raggiungimento di una gravidanza ovvero nel caso di sterilità permanente e irreversibile di uno o entrambi i partner. La PMA eterologa si fonda sugli stessi percorsi terapeutici della riproduzione assitita omologa.
- Si parla di eterologa femminile (ovodonazione) quando è previsto l’impiego di ovociti donati mentre gli spermatozoi sono del proprio partner.
- Si parla di eterologa maschile quando è previsto l’impiego di spermatozoi donati mentre gli ovociti sono della propria partner.
La fecondazione eterologa con donazione di spermatozoi può essere effettuata sia mediante tecniche di primo livello, come l’inseminazione intrauterina (IUI) , sia mediante tecniche di II livello, come la FIVET (Fecondazione in vitro) o la ICSI (Intra Cytoplasmatic Sperm Injection) .
Il Centro PMA di Clinica San Carlo offre la possibilità di ricorrere a tecniche di procreazione medicalmente assistita di tipo eterologo sia privatamente che con il Sistema Sanitario tramite la Banca di gameti Regionale Lombarda.
IL NOSTRO PERCORSO
Fecondazione assistita con donazione di ovociti e/o spermatozoi
Le fasi di questo percorso prevedono diversi steps diagnostico – terapeutici:
- consulenza specialistica per fertilità: inquadramento della coppia alla ricerca di gravidanza da parte dei nostri ginecologi e andrologi esperti in fisiopatologia della riproduzione e prescrizione degli esami necessari al trattamento.
- controllo esami e attivazione del percorso di PMA con donazione di gameti: visione dei risultati degli esami prescritti, richiesta di ulteriori valutazioni specialistiche, personalizzazione del percorso terapeutico, scelta e attivazione del percorso di PMA con donazione di ovociti e/o di spermatozoi.
- invio dell’ordine e selezione dei donatori: compilazione di scheda fenotipica, invio dell’ordine e selezione accurata di donatori/donatrici in base ai risultati di esami genetici e alla concordanza con le caratteristiche fenotipiche e cliniche della coppia.
- preparazione endometriale: preparazione endometriale su ciclo spontaneo modificato o con l’utilizzo di farmaci con monitoraggi ogni 2-3 giorni nel caso di donazione di ovociti. Nel caso di donazione di seme la donna, tramite punture sottocutanee, farà una terapia farmacologica per indurre la crescita follicolare multipla.
- scongelamento ovocitario o di seme: scongelamento degli ovociti crioconservati assegnati alla coppia o di pailettes di seme in caso di donazione di gameti maschili e concomitante prelievo ovocitario della partner femminile.
- fecondazione assistita e coltura embrionale: inseminazione mediante tecnica ICSI degli ovociti scongelati con gli spermatozoi del partner maschile o inseminazione mediante tecnica FIVET o ICSI degli ovociti freschi della partner femminile con gli spermatozoi del donatore. Successiva coltura in vitro degli embrioni ottenuti.
- eventuale crioconservazione embrionaria: eventuale crioconservazione degli embrioni sovrannumerari o di tutti gli embrioni in caso di specifiche condizioni cliniche (rischio di iperstimolazione e/o endometrio non idoneo) mediante tecniche di vitrificazione.
- traferimento embrionale (ET) e successivo test di gravidanza: trasferimento in utero dell’embrione (fresco o scongelato) tramite sottile catetere sotto guida ecografica e successivo test di gravidanza mediante prelievo di sangue.
Preservazione della fertilità e "Social Freezing"
Il prelievo e congelamento ovocitario ha lo scopo di preservare il potenziale di fertilità tentando di prevenire il deterioramento ovocitario età-correlato o secondario a specifiche condizioni mediche. Il prelievo e il congelamento ovocitario sono indicati per le pazienti:
- che debbano essere sottoposte a chemioterapia o radioterapia per patologie oncologiche;
- affette da mutazioni del gene BRCA nelle quali, a causa dell’elevato rischio d’insorgenza di un tumore ovarico, sia opportuna l’ovariectomia preventiva;
- con patologie in grado di determinare gravi danni del tessuto ovarico (endometriosi severa);
- con alterazioni genetiche associate a prematuro esaurimento della funzione ovarica (sindrome di Turner, delezioni del cromosoma X, premutazioni del gene FMR1);
- che intendano posticipare l’età della gravidanza per motivi personali.
Una condizione particolare e di recente affermazione in cui risulta molto importante la crioconservazione dei gameti femminili è il cosiddetto “social freezing”, ossia la possibilità di una donna di preservare la propria fertilità per esigenze personali, come ad esempio la mancanza di un partner, impegni di studio o lavoro, posticipando quindi la ricerca di una gravidanza ad anni successivi.
La crioconservazione dovrebbe essere eseguita preferibilmente entro il 35 esimo anno di età per poter garantire tassi di successo maggiori al momento dello scongelamento. Dopo i 38 anni si riduce significativamente la possibilità di ottenere una gravidanza a causa della progressiva diminuzione della riserva ovarica e dell’aumento di anomalie cromosomiche dovute all’età.
Laboratorio di Seminologia
Unitamente alle visite e alle consultazioni specialistiche, il Centro PMA di Clinica Polispecialistica San Carlo si caratterizza per una serie di attività strumentali diagnostiche.
Test seminali di primo livello
SPERMIOGRAMMA (Esame Seminale standard)
Lo spermiogramma viene eseguito con lo scopo di valutare la qualità del liquido seminale attraverso la verifica della concentrazione, della motilità e della forma degli spermatozoi.
Come confermato anche dall’Organizzazione Mondiale della Sanità (WHO), tale esame rappresenta lo strumento principale per la valutazione della fertilità maschile.
Ai fini dell’attendibilità dell’esame è fondamentale rispettare determinati parametri e seguire le istruzioni che verranno fornite dal personale del Centro PMA.
Il liquido seminale raccolto viene sottoposto inizialmente ad una valutazione “macroscopica” per la determinazione di alcune caratteristiche fisico-chimiche, in particolare l’aspetto, il volume, il pH, la viscosità. Successivamente viene effettuata la valutazione “microscopica” per la determinazione della concentrazione, della motilità, della morfologia e della vitalità degli spermatozoi, parametri principali che determinano la qualità dello sperma (vedi Infertilità maschile).
I risultati dello spermiogramma possono evidenziare:
Oligozoospermia: ridotta concentrazione di spermatozoi per ml
Astenozoospermia: ridotto numero di spermatozoi motili o con ridotta motilità
Teratozoospermia: ridotto numero di spermatozoi con forma normale
Azoospermia: assenza completa di spermatozoi nel citocentrifugato del liquido seminale
Ipoposia: volume dell’eiaculato inferiore alla norma
MAR (Mixed Agglutination Reaction) Test: Ricerca degli Anticorpi anti-spermatozoi
In condizioni normali, la barriera ematotesticolare protegge gli spermatozoi dal nostro sistema immunitario. Lo sperma può in certi casi presentare anticorpi con capacità di legare gli spermatozoi.
La causa di quest’alterazione non è sempre individuabile (pregressi trauma, infezioni, o ostruzioni in atto delle vie seminali, ecc). Gli anticorpi anti-spermatozoo interferiscono in diversi momenti con la funzione spermatozoaria, come la riduzione della motilità nelle vie genitali femminili e l’impedimento della penetrazione all’interno dell’ovocita. L’Organizzazione Mondiale della Sanità (WHO) raccomanda la ricerca di questi autoanticorpi nel liquido seminale. I test più utilizzati sono il MAR-Test e l’ IBT-Test.
Il risultato viene espresso come percentuale di spermatozoi motili legati da anticorpi rispetto al numero totale di spermatozoi analizzati.
EOSIN Test
L’Eosin Test valuta la vitalità degli spermatozoi mediante una tecnica colorimetrica che si basa sul principio per cui l’eosina penetra solo all’interno degli spermatozoi non vitali, che assumeranno in questo caso la tipica colorazione rosea.
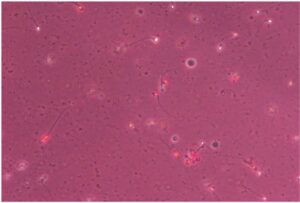
Test seminali di secondo livello
ANM (Aniline Blue) Test
Il Test al Blu di Anilina valuta il grado di maturità del nucleo degli spermatozoi.
Una elevata percentuale di spermatozoi con nucleo immaturo, che si colorano di blu, è associata ad una ridotta capacità di sviluppo dell’embrione.
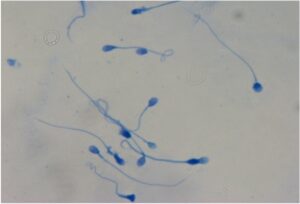
Test di frammentazione del dna spermatico
Indagini biomolecolari di introduzione relativamente recente nella pratica clinica quotidiana che valutano la percentuale di spermatozoi con DNA frammentato. Questi test sono particolarmente utili al clinico nel giudizio prognostico di fertilizzazione e di abortività spontanea.
Quelli da noi eseguiti sono due: AO (Acridine Orange) ed Halosperm.
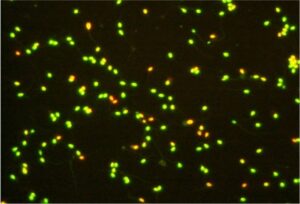
AO (Acridine Orange) Test
Il Test all’Arancio di Acridina valuta la percentuale di DNA denaturato a singola catena all’interno del nucleo dello spermatozoo. In questa procedura la testa degli spermatozoi con elevata quantità di DNA denaturato si colora di arancio, mentre gli spermatozoi normali si colorano di verde. La presenza di alterazioni del DNA in una percentuale elevata degli spermatozoi è associata a ridotta o mancata capacità di sviluppo dell’embrione.
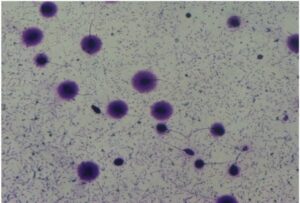
Halosperm
Il test si basa sul principio della dispersione della cromatina (SCD) degli spermatozoi.
Test diagnostico che permette di misurare i livelli di frammentazione del DNA nel liquido seminale in modo semplice, rapido e riproduciblie.
Attraverso una tecnica non invasiva che analizza spermatozoi da eiaculato, al termine del protocollo si procede con la colorazione del campione sul vetrino e l’osservazione al microscopio a luce diretta o a fluorescenza.
L’immagine visualizzata al microscopio, permette una rapida classificazione dei nuclei degli spermatozoi, in base alla presenza/dimensione o assenza dell’alone periferico di cromatina dispersa.
Tecniche di selezione degli spermatozoi
Tecniche proposte in caso di elevato indice di frammentazione del DNA spermatico:
MACS
Tecnica che consente di selezionare gli spermatozoi che non presentano danni o segni di apoptosi (morte cellulare) per poi utilizzarli nelle tecniche di riproduzione assistita.
La tecnica MACS (Magnetic Activated Cell Sorting) permette di selezionare gli spermatozoi con il DNA integro grazie a una selezione immunomagnetica separando gli spermatozoi sani da quelli morti o con DNA frammentato.
Microfluidica
La selezione degli spermatozoi con microfluidica permette di selezionare gli spermatozoi che presentano caratteristiche qualitative ottimali per il trattamento di procreazione medicalmente assistita attraverso membrane selettive, riducendo il numero di spermatozoi con DNA frammentato.
IUI (Inseminazione Intra Uterina)

L’ inseminazione intrauterina (IUI) costituisce il I livello delle tecniche di fecondazione assistita.
È la tecnica più semplice e consente di aumentare le chance di concepimento introducendo il liquido seminale precedentemente trattato direttamente in utero, superano il collo uterino e raggiungendo le tube, sede della fecondazione dell’ovocita.
Le principali indicazioni sono:
- infertilità idiopatica
- infertilità da fattore maschile di grado lieve
- endometriosi I-II stadio
- fattore cervicale
- alterazioni ovulatorie
- sindrome dell’ovaio policistico
L’inseminazione può essere eseguita su ciclo spontaneo oppure con una leggera stimolazione ormonale volta a supportare farmacologicamente la maturazione follicolare con farmaci orali o iniettabili.
La procedura consiste nel monitoraggio ecografico dell’ovulazione attraverso ecografie transvaginali e prelievi di sangue per il controllo dei valori ormonali per stabilire il momento migliore per l’inseminazione.
Il giorno dell’inseminazione si prepara il liquido seminale attraverso metodiche biologiche atte ad ottenere una piccola quantità di materiale seminale di qualità ottimale che viene depositato in utero mediante una speciale cannula flessibile.
Fecondazione in Vitro e Coltura Embrionaria
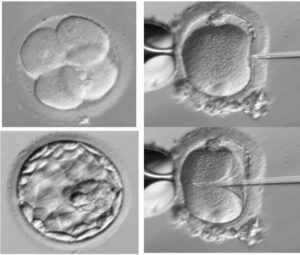
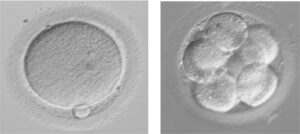
Gli ovociti prelevati al Pick up possono essere inseminati mediante tecnica FIVET o ICSI:
- Nella tecnica FIVET(Fecondazione in Vitro ed Embryo-Transfer) i gameti femminili e i gameti maschili vengono posti in una piastra contenente terreno di coltura idoneo e viene lasciata allo spermatozoo più competente la possibilità di penetrare l’ovocita in modo “naturale”;
- Nella tecnica ICSI(Intra Cytoplamatic Sperm Injection) un singolo spermatozoo viene introdotto all’interno dell’ovocita tramite un sistema di micromanipolazione.
Questa è la tecnica di elezione per i casi di infertilità maschile grave, oppure nei casi di mancata o ridotta fecondazione in seguito a tecnica FIVET.
Dopo circa 18 ore dal momento dell’inseminazione è possibile valutare l’avvenuta fecondazione degli ovociti, la coppia verrà informata del numero di ovociti fecondati dai biologi il giorno successivo al Pick Up.
Gli embrioni ottenuti verranno tenuti in coltura e trasferiti nella cavità uterina sotto guida ecografica tramite un sottile catetere.
Il trasferimento degli embrioni può essere effettuato:
- in seconda o terza giornata allo stadio di clivaggio;
- in quinta/sesta giornata allo stadio di blastocisti.
Considerati i miglioramenti nelle condizioni di coltura e nelle strumentazioni di laboratorio, allo stato attuale è possibile e consigliabile procedere alla coltura degli embrioni in vitro fino al 5°-6° giorno dal momento del Pick up, ossia fino allo stadio di blastocisti, qualora le condizioni lo consentano.
Ciò permette di garantire una migliore sincronia tra stadio embrionario ed endometrio, e permette, dato il maggior tasso di impianto delle blastocisti, di effettuare il trasferimento di un singolo embrione, evitando così il rischio di gravidanze gemellari.
Crioconservazione di Gameti ed Embrioni
CRIOCONSERVAZIONE DEGLI OVOCITI
Le principali condizioni in cui può essere indicata la crioconservazione degli ovociti nel contesto di un ciclo di PMA sono le seguenti:
- presenza di ovociti in sovrannumero rispetto a quelli da utilizzare al fine di ottenere il numero adeguato di embrioni da trasferire idoneo a garantire il miglior risultato alla coppia (come da Sentenza della Corte Costituzionale n 151/09);
- rischio di iperstimolazione ovarica: si crioconservano tutti gli ovociti prodotti in seguito alla stimolazione, per poi procedere allo scongelamento e alla inseminazione degli stessi durante un successivo ciclo;
- indisponibilità di gameti maschili per l’inseminazione il giorno del prelievo ovocitario;
- irregolarità dell’endometrio o rialzo del progesterone (per cui si avrebbe un aumentato rischio di fallimento dell’impianto degli embrioni prodotti e trasferiti);
- considerazioni etico-religiose personali delle coppie che non desiderano ottenere e crioconservare eventuali embrioni sovrannumerari.
CRIOCONSERVAZIONE DEGLI EMBRIONI
Le principali indicazioni alla crioconservazione degli embrioni* sono le seguenti:
- problematiche cliniche a carico della paziente che non permettono di effettuare l’embryo-transfer nel medesimo ciclo di stimolazione;
- produzione di embrioni sovrannumerari rispetto al numero effettivo di embrioni da trasferire;
- necessità di posporre il transfer, come nei casi di rischio di iperstimolazione ovarica (OHSS).
La crioconservazione embrionaria consente di aumentare i tassi di gravidanza cumulativa evitando ripetute stimolazioni ovariche.
Sia per gli ovociti che per gli embrioni la metodica in uso da tempo per la crioconservazione è la vitrificazione, cioè il metodo ultrarapido di crioconservazione in cui le cellule passano da 37°C a -196°C in meno di 1 secondo.
Vista la grande efficacia e le elevate percentuali di sopravvivenza e di successo riportate in letteratura, la vitrificazione è ormai la metodica più utilizzata, ed è quella con cui vengono crioconservati ovociti ed embrioni presso il Centro PMA di Clinica Polispecialistica San Carlo.
*La Sentenza della Corte Costituzionale n. 151 del 2009, in deroga al principio generale del divieto di crioconservazione, consente la crioconservazione degli embrioni fino alla data del trasferimento, da realizzare non appena possibile.
CRIOCONSERVAZIONE DEGLI SPERMATOZOI
La crioconservazione in azoto liquido permette di conservare gli spermatozoi per un tempo indefinito e rappresenta pertanto un utile strumento di preservazione della fertilità. Alcune delle Indicazioni alla crioconservazione degli spermatozoi ono le seguenti:
- uomini affetti da severa oligozoospermia che vedono progressivamente decrescere la loro fertilità nel tempo, fino a rischiare l’azoospermia;
- uomini che devono essere sottoposti a terapie mediche (chemioterapia, radioterapia) o chirurgiche (prostatectomia) che potrebbero danneggiare la fertilità;
- uomini che per motivi professionali sono esposti a sostanze genotossiche;
- uomini affetti da azoospermia (ostruttiva o secretoria) che sono stati sottoposti con esito positivo al recupero chirurgico di spermatozoi dai testicoli (TESE, MicroTESE).
Per contattare la PMA
- centropma@clinicasancarlo.it
- Clinica Polispecialistica San Carlo - Via Ospedale, 21 - Paderno Dugnano (MI) Edificio H - Piano 1 Per prenotazioni esami seminali scrivere a: andrologia@clinicasancarlo.it
ATTENZIONE è importante lasciare i propri recapiti telefonici per essere ricontattati.
BERNASCONI ELENA
Ginecologia e Ostetricia

CASTIGLIONI FABRIZIO
Urologia e Andrologia
BASILI LUDOVICA
Ginecologia e Ostetricia
CASTORINA PIERANGELA
Genetica medica
COLOMBO FRANCESCA
Ginecologia e Ostetricia
DOLDI NICOLA
Ginecologia e Ostetricia
GANDOLFI ANDREA
Ginecologia e Ostetricia
GOGGI GIOVANNI
Endocrinologia e Malattie del Ricambio
COTTI LAURA
Psicologia
TESTA PATRIZIA
Biologa
CAMINITI GIUSEPPE
Biologo
MONTI VALENTINA
Biologa, Referente Qualità Centro PMA
SANTOLI MARCO
Biologo
AMBROGGI BEATRICE
Ostetrica
BORRONI PAOLA
Ostetrica
MIRANDA SILVIA
Ostetrica
MASCIOCCHI FEDERICA
Ostetrica